Cancer/Radiothérapie杂志刊载[ 28 (2024) 547–552]法国université de Bretagne occidentale, 的Vincent Bourbonne, Luc Ollivier , Delphine Antoni 等撰写的《脑放射性坏死的诊治。Diagnosis and management of brain radiation necrosis》(10.1016/j.canrad.2024.07.014)。
脑放射性坏死(BRN)是立体定向放疗(SRT)的一个重要而复杂的副作用。识别BRN与局部肿瘤复发是至关重要的,这需要先进的诊断技术和多学科方法。BRN通常在治疗后数月至数年出现,MRI显示放射影像学改变,并可能产生神经系统症状。主要的危险因素包括受照射脑组织的体积、照射剂量和先前的放疗史。本文回顾了BRN的诊断过程,强调了评估基线风险、临床评估和先进成像方式的重要性。多模态成像提高了诊断的准确性,并有助于鉴别BRN与肿瘤复发。
治疗方法因症状而异。无症状的BRN可以通过定期影像学监测,而有症状的BRN通常需要皮质类固醇来减轻炎症。像贝伐单抗这样的新兴疗法在临床试验中显示出希望,具有显着的放射影像学和症状改善。手术干预可能是必要的组织学确认和严重的,治疗难治性病例。正在进行的研究旨在提高诊断准确性和治疗效果,提高患者的预后和生活质量。这篇综述强调需要多学科的方法和持续的进步来解决脑肿瘤患者BRN带来的挑战。
1. 引言
在过去几年的原发性和继发性脑肿瘤的管理中,脑立体定向放射治疗(SRT)有巨大的发展。在脑转移瘤(BMs)的背景下,全脑放疗一直是唯一的放疗管理。放射治疗技术的进步和肿瘤内科药物颅内疗效的提高,延长了总体生存期,从而提高了脑转移瘤的发病率,导致脑转移瘤患者的管理发生了一场革命。脑转移瘤的大小和数目是SRT病例的历史限制因素。在尺寸方面,即使在大的脑转移瘤(≧2cm直径),SRT提供了高度的局部控制。关于脑转移瘤的数目,SRT现在是最多4个脑转移瘤患者的主要治疗选择,甚至有研究对最多10个脑转移瘤患者进行了评估。靶点数目和大小的增加必然导致脑受照剂量的增加,从而导致脑放射性坏死(BRN)。
BRN是脑放射治疗(RT)的一种复杂副作用,通常发生在SRT后的几个月到几年。发病率差异很大,有几个队列报告的发病率高达50%,时间在6至36个月不等。大多数队列报告的发生率为10%至25%。随着时间的推移,RT可诱导内皮细胞损伤,受损内皮细胞修复不足和BBD导致组织缺氧和缺氧反应基因上调。这增加了HIF-1 α的分泌,从而导致基因表达的变化,而这种变化在放射后持续数周,导致血管内皮生长因子(VEGF)的释放增加。这引起血脑屏障通透性的增加,肿瘤坏死因子α (NF-Kb)的上调,从而促进炎症微环境,进而上调与血脑屏障相关的细胞间粘附分子1 (ICAM-1)。这会促进渗出和脑水肿,造成额外的缺血、缺氧,最终导致放射性脑坏死。
BRN可能与后续脑磁共振成像的放射影像学改变和/或神经系统症状相关。以前已经确定了几个风险因素。在非强制性组织学确认的队列和死亡为主要竞争风险的患者中,对BRN发生的所有预后特征进行了评估。这种情况正在改变,随着预期寿命的增加,BRN变得和局部复发一样麻烦。诊断本身就是一个挑战,因为肿瘤生长是主要的放射改变。
鉴于BRN的特殊治疗管理,鉴别BRN和局部复发(LR)是一个主要问题。在这个叙述性的综述中,我们将通过诊断过程时,提出一个可能的放射性坏死的情况。在开始新的预测、诊断和治疗观点之前,将讨论治疗管理。
2. 如何认识和评估放射性坏死的风险
如前所述,BRN是一个复杂的情况,需要多学科评估。
诊断需要以下几个步骤:
•放射性坏死基线风险评估;
•临床评估;
•特异性影像学检查:多模态MRI伴或不伴分子成像;
•多学科委员会
2.1. 放射性坏死基线风险评估
初始脑转移瘤(BM)体积、照射剂量和既往放疗史是BRN的三个主要危险因素。其他特征,也不应忽视如全身治疗。在评估BRN风险时,应参考已提供的治疗,同时考虑到三个主要风险因素。脑转移瘤体积以及因此而产生的受辐照体积与BRN的风险直接相关。例如,在接受中位剂量为21 Gy(范围15-22)的单次分割治疗的患者中,脑转移瘤≤0.5 cm的患者1年BRN率为2.9%,而脑转移瘤大于1.5 cm的患者1年BRN率为37.8%[6,7]。分割可以减轻辐照体积的负面影响。在Lehrer等2019年的荟萃分析中,2至3cm直径脑转移瘤患者的BRN发病率在单次分割组(SF-RT)中为23.1%,而在多次分割组(MF-RT)中为7.3%。多次分割方案与1年LC率无显著性升高相关(77.6%对92.9%,P = 0.18)。剂量体积应考虑先前接受过放疗的累积放射治疗。这些剂量体积表示为VxGy,即接受至少xGy的平均体积。在考虑SFSRT时,研究最多的是10 - 12 Gy等剂量。在V10 Gy大于12.6 cm3或V12 Gy大于10.9 cm3的SRT过程中,BRN率高达47%。有不同剂量阈值的报道。这些结果后来得到Noël等人的证实,并被纳入法国剂量限制指南以及ASTRO指南(V12Gy < 10 cm3)。3次分割和5次分割方案的剂量限制也可用。2018年,Milano等人提出了一种关注BRN的正常组织并发症概率工具。对于3次分割方案,当对大脑的V19.6Gy大于20 cm3时,BRN率估计为41.5%。在再程照射的情况下,报道了特定的限制,如V18-12Gy, Minniti等首先将其描述为在第一次放射治疗过程中接受超过12Gy的脑体积与在第二个放射治疗过程中接受超过18Gy的脑体积的交叉点。在外部队列中验证了脑V18-12Gy, BRN预后的截止值为>7.6 cm3。在单次放射治疗中,BRN的发生风险与V40Gy(剂量累积后)相关。
尚不清楚酪氨酸激酶抑制剂、免疫检查点抑制剂或抗药偶联物等全身性治疗或其他特征(全身性疾病,如糖尿病、性别等)是否对BRN风险有明显影响。已经提出了指南,最终在进行RT时采用全身治疗,但不针对脑RT。
2.2. 临床评估
BRN发生在先前照射的RT区域内。BRN结合血管损伤、炎症和坏死,可导致非特异性衰弱症状,如力量丧失、敏感性丧失、癫痫,这取决于BRN的定位。当出现症状时,BRN还可伴有颅内压症状(头痛、恶心和/或呕吐)。临床检查在诊断路径中往往使用不良,因为通常会误导,而在无症状的BRN中正常(> 70%的病例取决于队列)或类似局部复发。
2.3. 影像检查
法语区神经肿瘤学家协会和法国放射肿瘤学协会(the association French-speaking neurooncologists and the French society of radiation oncology,Anocef和RecoRadTM)的指南建议脑SRT后每3个月进行一次MRI随访。根据中心不同,随访MRI通常包括几个序列,包括钆剂注射前后的弥散和表观弥散系数,T2 flair, T1。通常,MRI会显示对比后增强,表明血脑屏障破坏区域,被flair序列上的高信号包围(脑水肿)。可见中央低信号(坏死)和所谓的“T1-T2错配”。有几个名字被使用:“肥皂泡”,“瑞士奶酪”或“切青椒”[“soap-bubbles”, “Swiss-cheese” or “cut green pepper”]。进化是不确定的,因为BRN自然减少,但可以保持稳定几个月,甚至增加并导致症状恶化。BRN的基本MRI评估往往存在很大的多变性。先进的MRI技术已经被提出,可以总结如下:
•弥散加权成像(DWI):检测水分子在组织中的扩散;BRN典型表现为弥散受限,DWI呈高信号;
•弥散张量成像(DTI):评估白质完整性,显示BRN中白质束的中断为分数各向异性的变化;
•灌注加权成像(PWI):评估脑血流量(CBF)和脑血容量(CBV);与过度灌注的复发性肿瘤相比,BRN通常灌注减少。通常使用2到2.1的临界值来区分BRN和局部复发;
•磁共振波谱(MRS):分析化学成分,BRN常显示脂质和乳酸峰值升高,N -乙酰天冬氨酸(NAA)水平降低,表明坏死和细胞膜破裂。
对16项研究的解剖MRI分析,包括726个病变,显示合并敏感性为79%,特异性为76%。当涉及到动态对比增强(DCE)灌注时,涉及114个病变的四项研究的数据表明,总敏感性为74%,特异性为92%。在12项研究中动态对比敏感性(DSC)灌注检查了418个病变,显示出83%的总敏感性和78%的特异性。对于弥散加权成像,涵盖288个病变的7项研究显示,合并敏感性为67%,特异性为79%。MRS有4项研究和54个病变,其敏感性和特异性分别为80%和78%。最后,在涉及375个病变的6项研究中回顾了联合成像技术,其总敏感性为84%,特异性为88%。基于相同的研究,不同研究的真实(TPV)和阴性(NPV)预测值差异很大,常规MRI、DCE、DSC、DWI、MRS和综合分析的平均真实预测值(TPV)分别为83.0%、91.1%、86.6%、80.2%、100%和85.5%,阴性预测值(NPV)分别为72.9%、74.3%、86.1%、73.9%、50.0%和90.4%。
Li等人采用类似的方法,但侧重于核医学,评估了诊断BRN方面不同核医学模式在的表现。混合多种氨基酸和PET FDG的总体敏感性和特异性分别为0.85和0.88。没有一种同位素的表现明显优于另一种同位素。双相PET-FDG具有比PET-DOPA等特定同位素更大的可用性和更容易获得的优势。对于双期PET-FDG,保留指数> 0.19有利于局部复发,而对于PET-DOPA,核医生依赖于最大病变与最大背景比(> 1.6)和最大病变与最大纹状体比。Lizzaraga等也提出了一个基于视觉评估病变摄取与正常脑组织和纹状体相比较的四分制)。评分≥2(病变摄取大于或等于纹状体摄取)导致敏感性为81.3%,特异性为84.3%(预测局部失效)。考虑到数据的异质性,在手术前缺乏确定性,以及大多数文献中缺乏组织病理学证实,评估多模态成像的真正益处是一项复杂的任务。目前尚不清楚哪种成像方式对BRN的诊断效果最好。然而,多模态似乎是安慰诊断的关键。临床医生应该依靠现有的成像技术,多模态MRI灌注是第一步。影像结果的一致性是决策的关键因素。
2.4. 多学科委员会
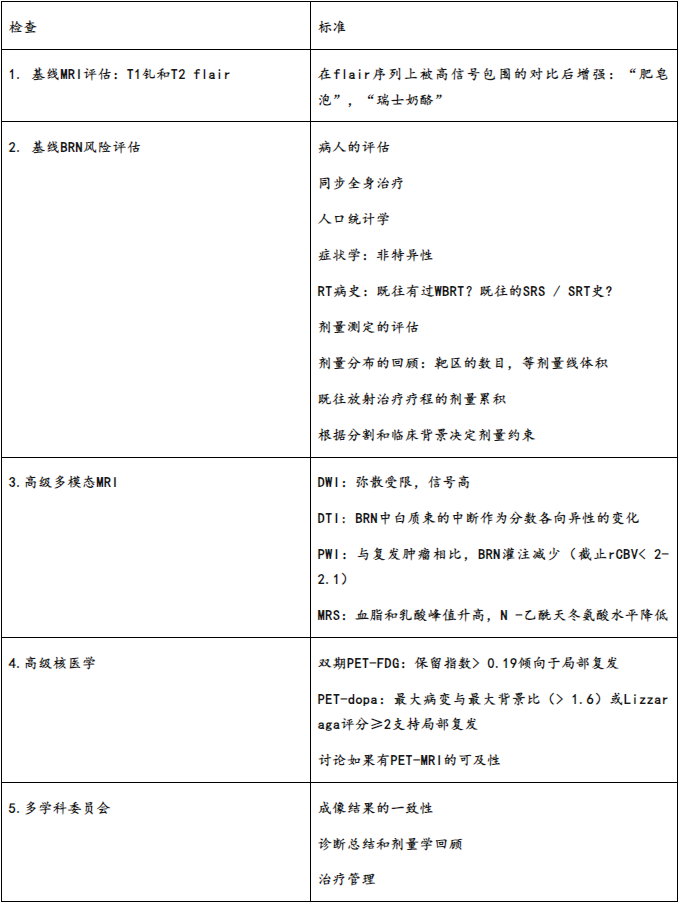
放射肿瘤学医生、神经外科医生、专攻神经肿瘤学的放射影像科医生、核医学的医生和内科肿瘤学医生都可以在疑似BRN或局部复发患者的管理中发挥作用。这些病例应该在专门的多学科委员会内进行讨论。如果疑点持续存在,尤其是无症状的BRN,通常需要仔细观察,并在6周后进行新的评估(MRI伴或不伴PET)。纵向监测为诊断和治疗提供了有价值的信息。诊断检查建议见表1。
表1。疑似脑放射性坏死的诊断检查
BRN:脑放射性坏死;dopa:二羟基苯丙氨酸;DTI:弥散张量成像;DWI:弥散加权成像;FDG:氟脱氧葡萄糖;MRI:磁共振成像;MRS:磁共振波谱;PET:正电子发射断层扫描;PWI:灌注加权成像;rCBV:相对脑血容量;RT:放射治疗;SRT:立体定向放疗;SRS:立体定向放射外科;WBRT,全脑放疗。
3. 何时以及如何治疗?
如前所述,BRN可能无症状,也可能有症状。无症状BRN不应导致特异性治疗,除非伴有大面积病灶周围脑水肿和/或发生在脑功能区。在这种情况下,可以在短时间内以0.5-1 mg/kg的剂量给药皮质类固醇,以预防症状。仔细观察也是可能的,每6周进行一次多模态MRI检查。在某些1级BRN(无症状和小体积)病例中,也可以讨论3个月的间隔。在症状性BRN的情况下,皮质类固醇是减少炎症的一线治疗。根据症状以及磁共振通(adapted to the symptoms and the MRI),常在短时间内以1 - 2mg /kg的剂量处方,剂量缓慢渐进减少。考虑到皮质类固醇的短期和长期副作用,这种减少是必要的。然而,目前还没有关于减少皮质类固醇的指南发表。
手术有几个优点。它允许组织学诊断,同时作为一种治疗,当包括在手术切除。如果出现肿块占位效应,手术也能起到缓解作用。除了需要进行组织学检查和出现危及生命的症状外,对于有症状的BRN,尤其是皮质醇抵抗性或皮质醇依赖性的BRN,可建议进行手术治疗。尽管进行了良好的皮质醇治疗,但皮质醇抵抗的定义是症状的持续,而皮质醇依赖的定义是减少剂量后临床复发。然而,手术治疗这种适应证是罕见的。事实上,考虑到手术的影响,决定应该平衡固有的风险和其他治疗的疗效。
贝伐单抗(一种抗VEGF抗体)是最常用的医学治疗方法之一。一项小规模的安慰剂对照III期试验支持其使用。已经提出了几种方案,5或10 mg/kg/2周和7.5 mg/kg/3周是最可用和最适用于最终其他全身治疗的方案。关于持续时间,通常在MRI评估前进行4 - 6个周期。在Khan等的荟萃分析中,89例患者中有93.3%在贝伐单抗疗程后出现影像学反应。在最初的85名患者中,10%的患者症状稳定,48%和40%的患者症状改善或完全缓解。这些结果在第二次荟萃分析中得到证实,稳定性/改善率为87.7%。虽然剂量似乎不会影响疗效,但剂量增加会导致不良事件的高发率。副作用不应被忽视,因为根据CTCAE 5.0分类,贝伐单抗与22.2%的3级和5.6%的4级不良反应相关。最常见但轻微的是高血压和蛋白尿,而最常见的致命不良事件是肺出血(23.5%)、中性粒细胞减少(12.2%)和胃肠道穿孔(7.1%)。在贝伐单抗下,血栓栓塞事件,特别是缺血性中风的风险更高。最近启动了一项III期试验,比较贝伐单抗与安慰剂在更大队列中治疗皮质醇抵抗性或皮质醇依赖性BRN的四个周期。EUCT 2024-510893-25-00)。提出了一个流程图来组织治疗管理(图1)。
图1。疑似脑放射性坏死治疗管理的决策算法。
4.观点
4.1. 成像模式
化学交换饱和转移(CEST)成像通过检测饱和质子从内源性分子或给药造影剂转移到水中来增强对比度,提供有关组织组成和代谢变化的详细分子信息。例如,酰胺质子转移(APT) CEST成像测量酰胺质子和水之间的交换,这有助于识别与肿瘤相比代谢活性较低的坏死组织。动脉自旋标记是一种通过磁性标记的血液质子获得的无造影剂灌注技术,其对脑转移瘤的数据有限,但对高级别胶质瘤的了解越来越多。深度学习和人工智能导致了几种预测和/或分类BRN的方法。
已经开发了几种放射影像组学模型,试图超越常用脑成像的定性分析。这种模型的主要局限性仍然是小队列以及缺乏组织学证据。这就解释了为什么尽管有有趣的结果,这些先进的方法却无法达到临床应用。这可以用它们的技术方面来解释,但也可以用缺乏外部和多中心验证来解释。PET-MRI结合了两种成像方式的优势,便于空间配准,对BRN的诊断有很大帮助,但需要进一步评估。
4.2. 过去和新兴的治疗方法
已经探索了激光间质热疗法(LITT)或药物治疗(维生素E和己酮可可碱)等治疗方法,并对BRN的治疗产生了潜在的益处。LITT是一种微创手术选择,在激光导管周围提供病灶内热疗,消融掉功能失调的内皮细胞和星形胶质细胞,从而产生抗血管生成作用。对于适合手术的BRN, LITT与71.2%的患者症状改善或稳定相关。这种做法似乎很少见,只在特定的中心发展。
高压氧疗法(HBOT)包括在加压室内呼吸纯氧,在促进辐射损伤组织愈合方面取得了一些成功。HBOT缺乏一级证据,但几个案例研究和队列显示了一些益处。
Boswellia serrata(齿叶乳香)最近被引入作为治疗BRN的一种选择。由于缺乏前瞻性和可比性数据,该研究仅依赖于病例报告和小型回顾性队列,可能具有未来的研究价值。
5.结论
立体定向放射治疗脑肿瘤的BRN仍然是一个复杂的挑战。准确的诊断,区分BRN和局部复发,是至关重要的,并依赖于先进的多模式成像和多学科评估。皮质类固醇是症状性BRN的主要治疗方法,而贝伐单抗等新兴疗法显示出希望。正在进行的先进成像技术和新治疗方法的研究旨在提高诊断准确性和患者预后,加强BRN的整体管理。