颅底脊索瘤(Skull-Base Chordoma,SBC)为起源自胚胎期脊索残瘤组织的一类强侵袭性、高复发率的恶性骨肿瘤。因手术难全切,残瘤的治疗手段又极为有限(放疗抵抗率高,无切实有效的靶向药物),该类患者总体预后极差。目前,颅底脊索瘤尚无基于临床预后的蛋白质基因组分型,这使得其诊疗靶点的探索面临缺乏有效研究方向和基础数据的困境。
2024年9月27日,复旦大学附属华山医院赵曜教授团队和复旦大学丁琛教授团队合作,在Nature子刊Nature Communications杂志在线发表题为“Proteogenomic characterization of skull-base chordoma”的研究论文。该研究通过包含基因组、转录组、蛋白质组和蛋白质翻译后修饰组的多组学测序分析,构建了颅底脊索瘤的蛋白质基因组特征图谱。在基因组层面,颅底脊索瘤中存在的染色体不稳定性,其与临床预后显著相关。后续研究进一步基于蛋白质基因组特征分析,发现细胞周期、线粒体相关蛋白、DNA损伤修复等机制通路参与调控了颅底脊索瘤肿瘤增殖、复发、放疗抵抗等生物学特性。此外,相关的免疫分型和蛋白分型也为后续颅底脊索瘤的精准化临床诊疗奠定了基础。
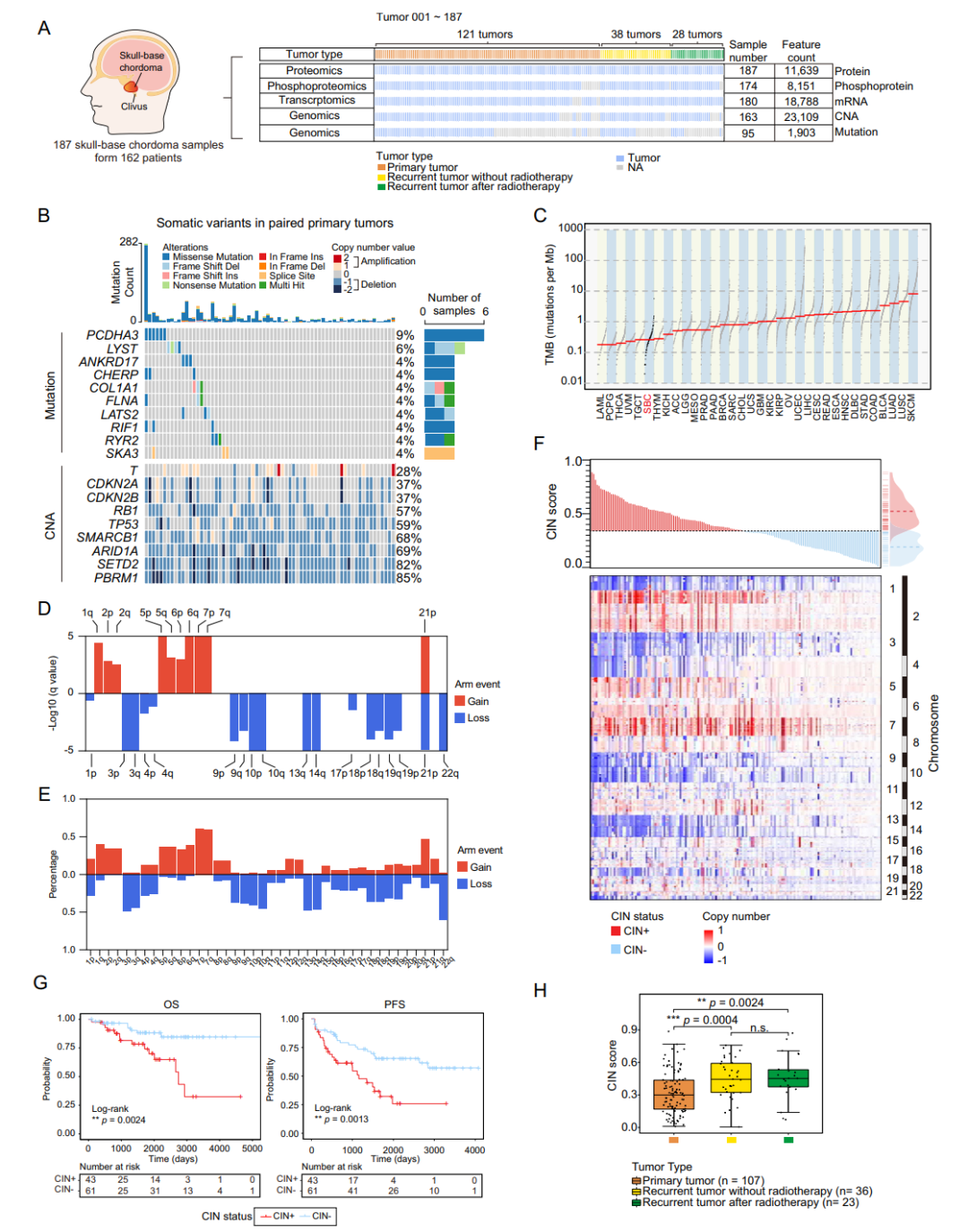
本研究收集了来自华山医院的162例SBC患者的187个肿瘤样本,包含121例原发肿瘤和66例复发肿瘤。利用全外显子组测序、RNA测序、蛋白质组学和蛋白质翻译后修饰组学测序数据,从四个层面对SBC样本进行分析,构建了SBC的蛋白质基因组特征图谱。这一大样本多层面的分析为后续进一步探索SBC的分子机制奠定了基础,并显示了基因和蛋白质在SBC肿瘤进展中的相互作用。
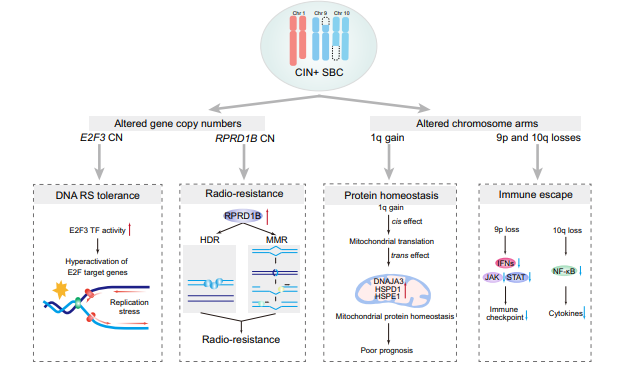
基因组测序分析显示,大多数SBC样本的肿瘤突变负荷较低,这与既往的研究相符。但是SBC中存在显著的染色体不稳定性(Chromosomal instability,CIN)现象,表现为特定染色体的扩增和缺失。进一步研究发现,结合临床数据,通过CIN水平可将SBC划分为CIN高(CIN+)与CIN低(CIN-)两种状态,其中CIN+状态与SBC的不良预后显著相关。
图1. SBC的多组学测序分析队列
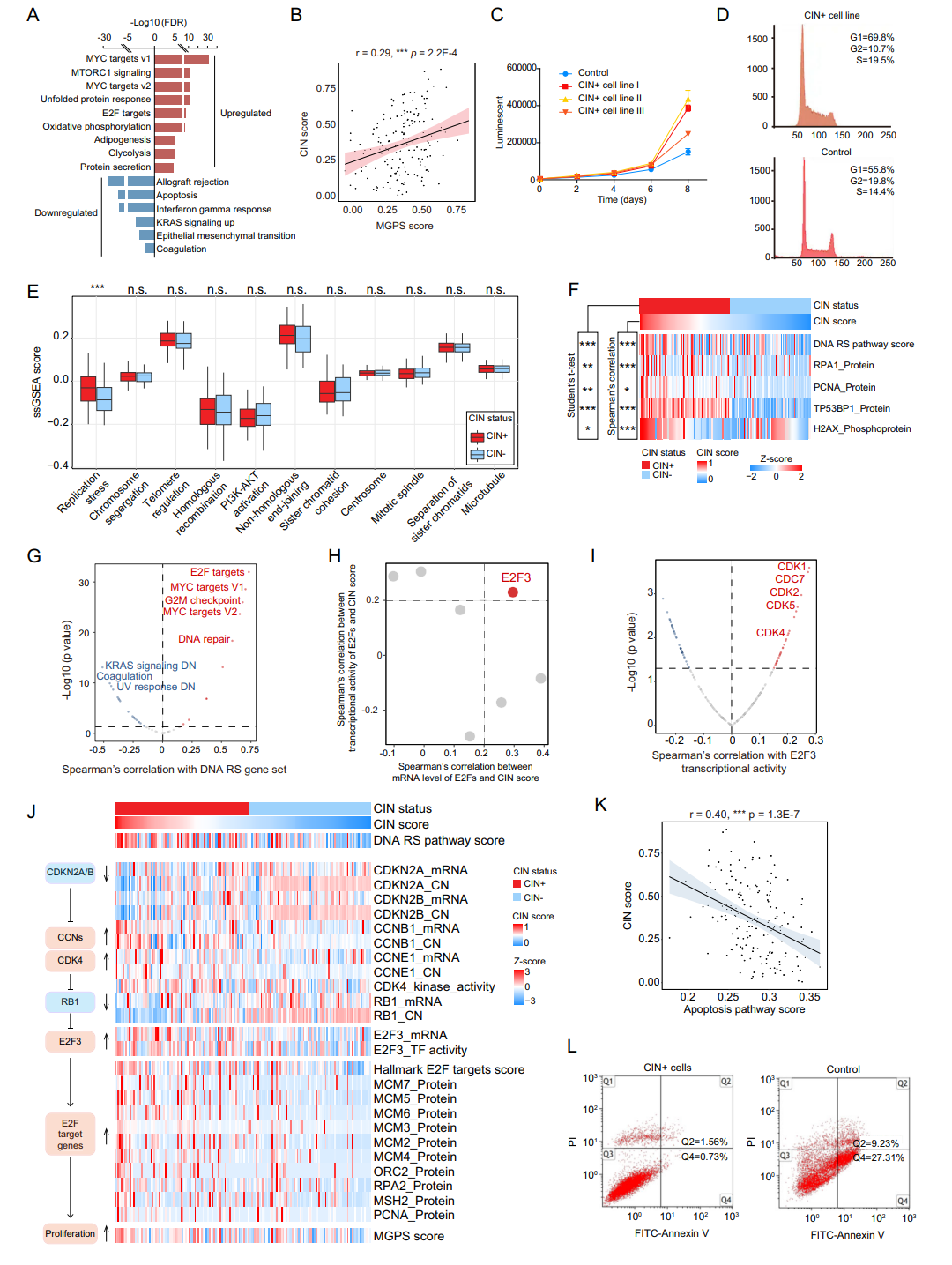
为了深入探索CIN对SBC的作用,本研究比较了CIN+和CIN-肿瘤在转录组和蛋白质组之间的差异。CIN+的SBC中MYC靶点、mTORC1信号通路、未折叠蛋白反应和E2F靶点通路显著上调,而凝血和细胞凋亡通路显著下调。这些上调的通路提示CIN水平的升高可能促进SBC肿瘤增殖和细胞周期进展,进一步的分析显示CIN诱导的DNA复制应激(DNA RS)和有丝分裂错误等途径在其中产生作用。这潜在途径中,DNA RS与E2F靶点的相关性最强,相应的实验也验证了CIN+的SBC通过E2F3转录因子及其上游调控元件(如CDK4)调控肿瘤细胞周期进展和增殖。
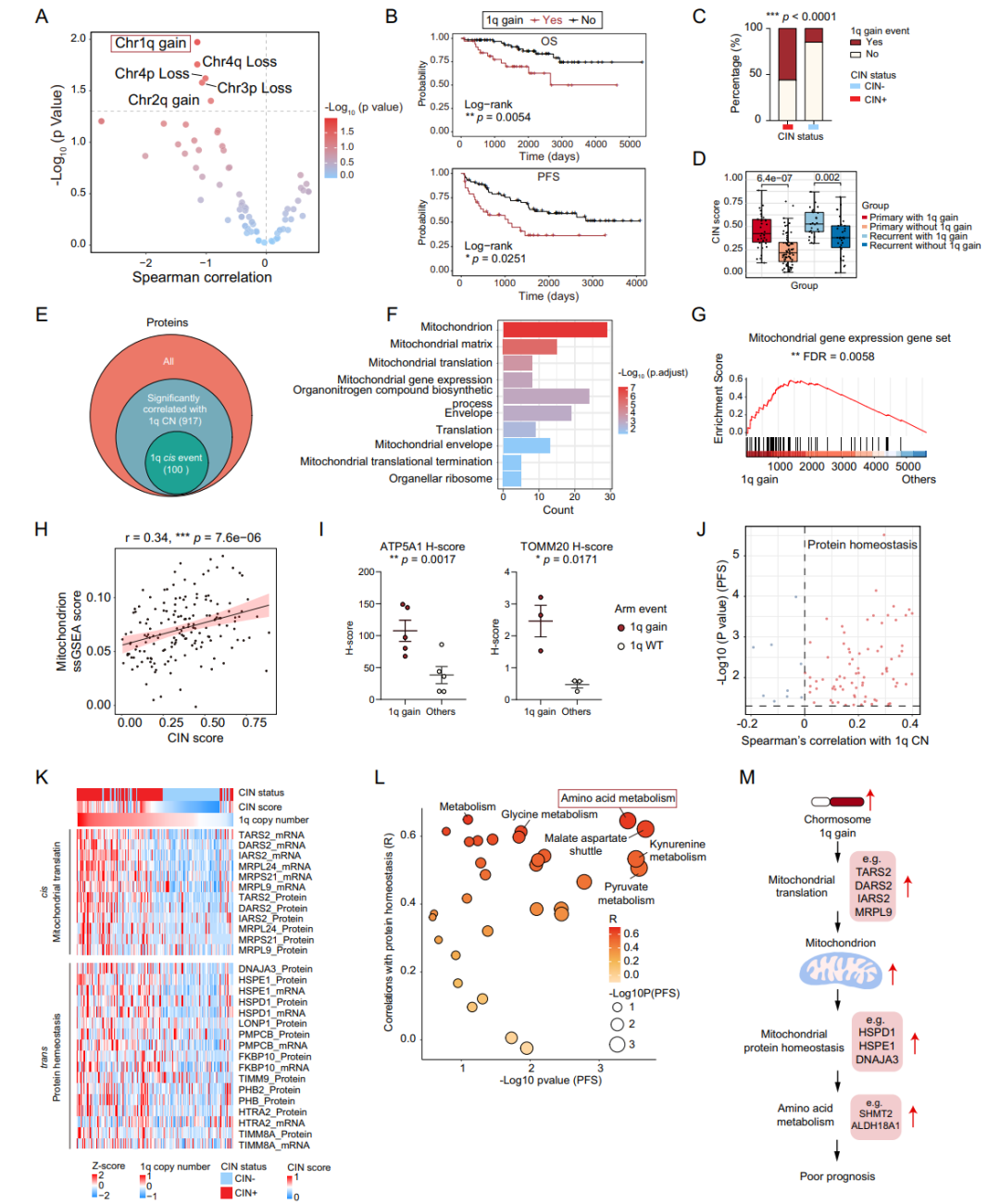
对基因组的进一步分析则发现1q染色体的扩增与SBC患者的不良预后显著相关。结合SBC的蛋白质组数据,1q染色体的扩增与线粒体功能相关的蛋白质水平失调有关,提示线粒体蛋白质稳态失调也可能是导致SBC增殖的机制之一。
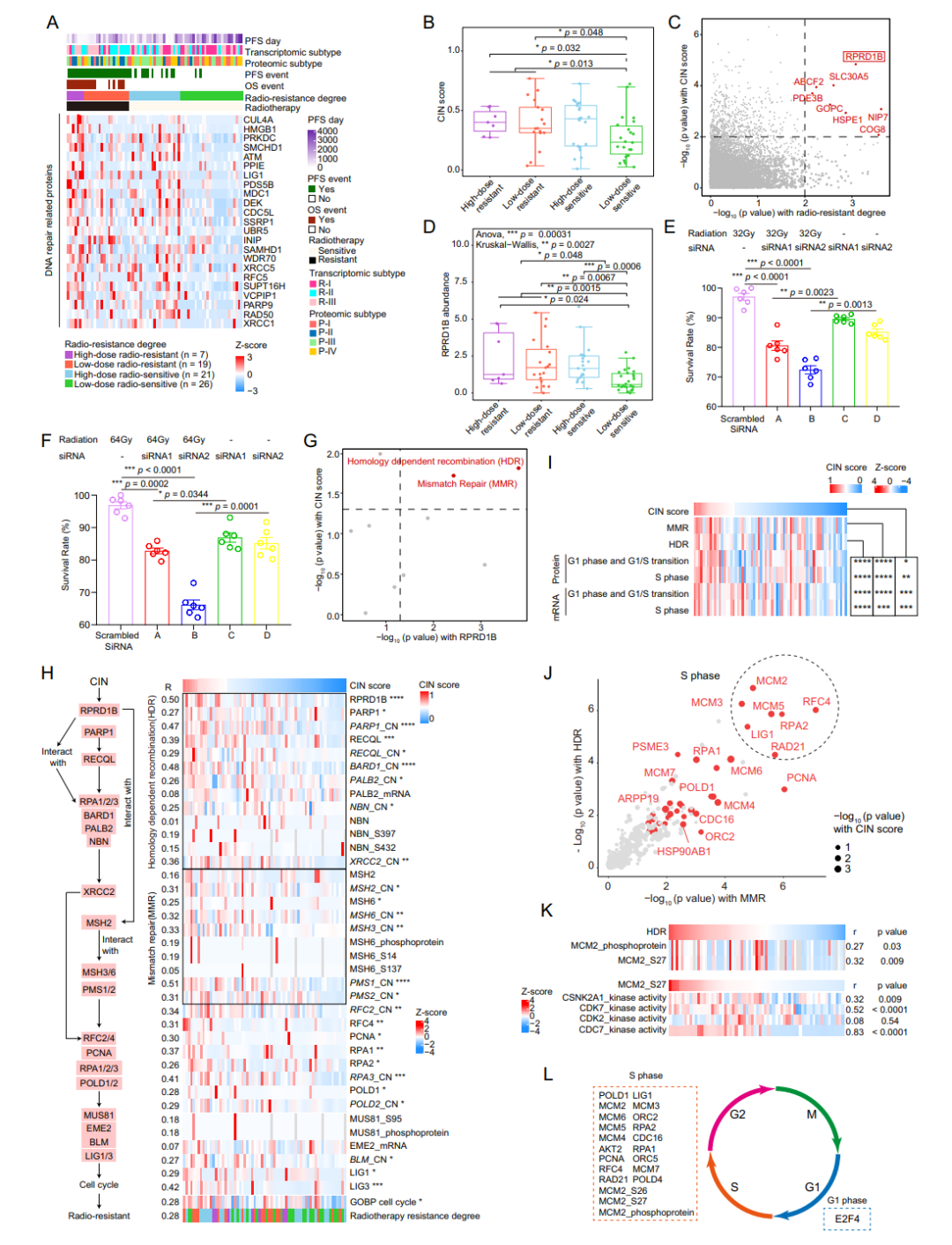
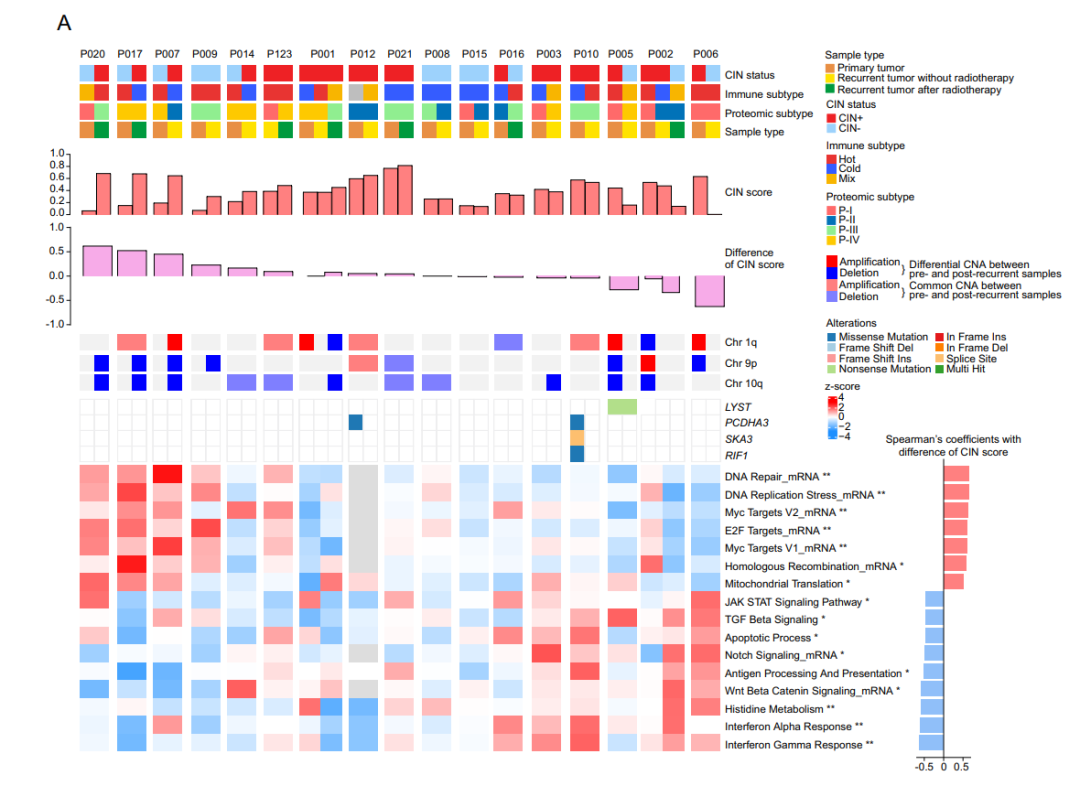
SBC治疗效果不佳的一个重要因素是对其对放射治疗的抵抗。为了确定放疗抵抗的潜在生物标志物和机制,本研究重点分析了放疗后长期随访患者的多组学数据。临床队列中有91例患者接受过放疗,本研究纳入了其中73例患者的接受放疗前的手术病理样本。这73例样本的分析结果显示,RPRD1B的表达水平与SBC患者对放疗的敏感性有关。高表达的RPRD1B蛋白和上调的DNA损伤修复通路可能是SBC患者放疗不敏感的潜在原因,这为SBC患者后续个体化放疗方案的制定提供了新思路。
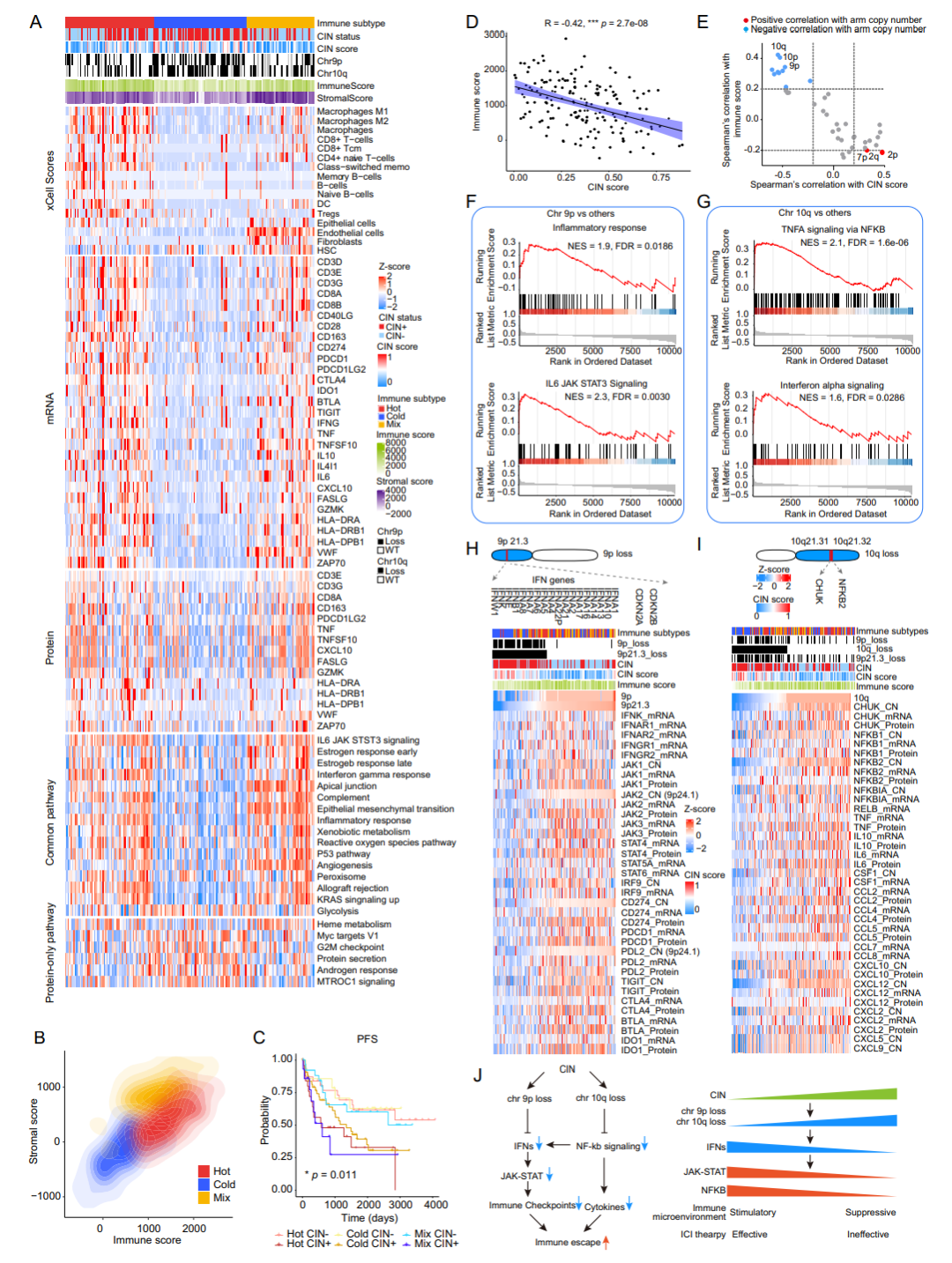
免疫治疗也是肿瘤治疗的一个潜在方向,本研究中结合多组学数据,构建了SBC的免疫分型,发现其中的免疫冷肿瘤通常伴随9p和10q染色体的缺失。这种基因组缺失可能导致肿瘤微环境中免疫细胞的浸润减少,影响免疫监视,促进肿瘤免疫逃逸。这一发现为后续SBC的免疫治疗中将免疫冷肿瘤转变为热肿瘤提供了依据和方向。
图5. SBC冷肿瘤亚型与9p/10q染色体的缺失相关
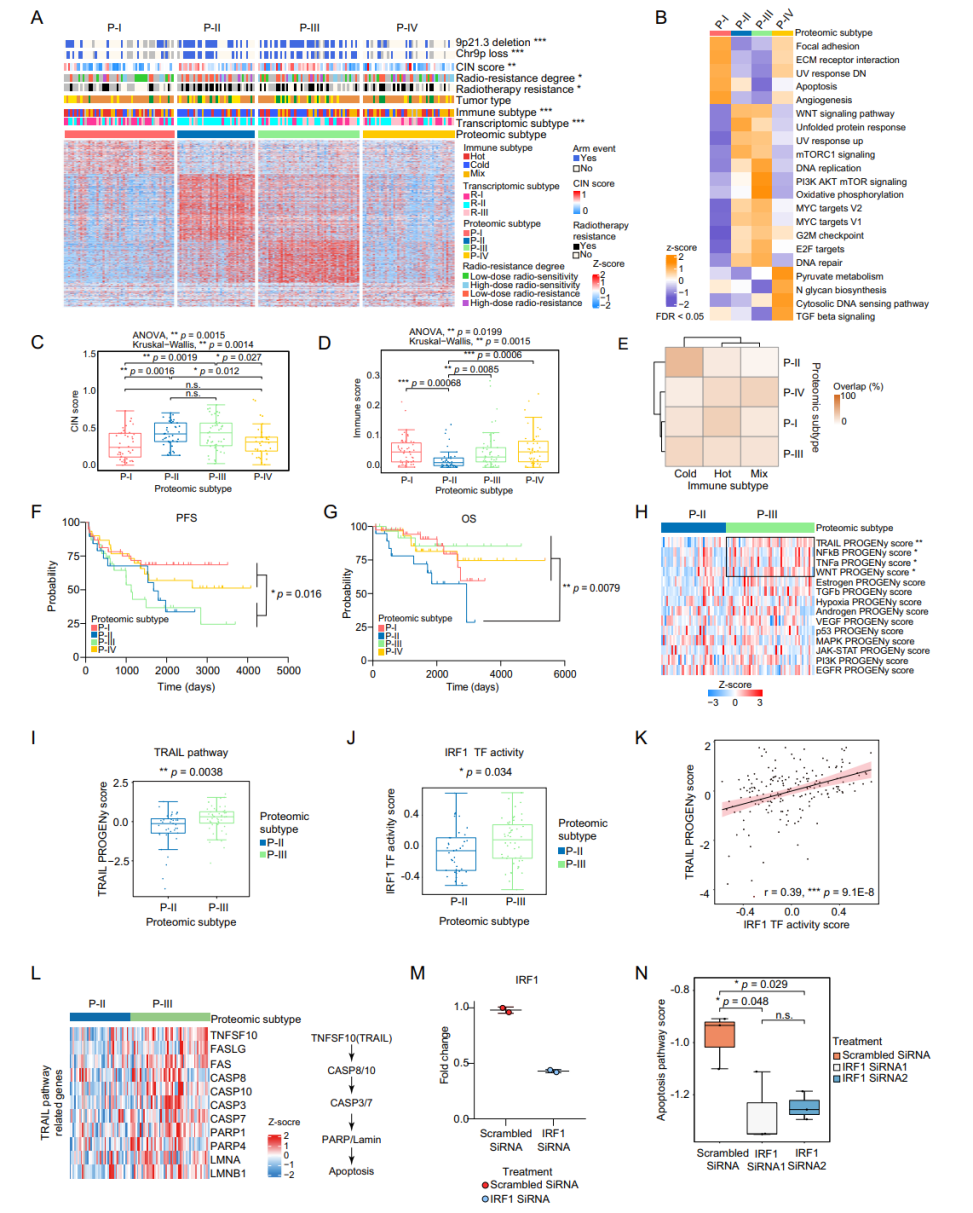
在蛋白质组和蛋白质翻译后修饰组学层面,本研究通过蛋白质组无监督聚类分析,确定了SBC的四个蛋白质组亚型(P-I、II、III和IV)。这些亚型在生物学特征和临床表现上存在显著差异,P-II和P-III亚型的CIN水平显著高于P-I和P-IV亚型。同时,P-II亚型与更差的预后和更高的复发风险相关。这一分型结合了基因组分型,进一步显示了SBC中基因与蛋白质的相互作用,为后续SBC的精准化诊疗提供新思路。
由于单个患者的原发性和复发性肿瘤在基因和蛋白表达谱上可能存在显著差异,本研究对同一患者的SBC复发前后进行了两两比较分析。结果显示,CIN状态的变化会导致相应的蛋白表达及信号通路的变化,揭示了SBC复发可能具有不同的分子机制,并表明复发可能导致蛋白质组的重塑。这一结果为SBC患者的预后预测和临床指导个体化术后治疗方案提供了依据。
综上所述,本研究系统性地揭示了SBC的蛋白质基因组特征,明确了SBC中存在CIN现象,并可能通过基因拷贝数变异或染色体臂事件,调控SBC细胞周期、放疗敏感性、蛋白质稳态和免疫逃逸,从而影响SBC的预后。这些发现为未来SBC的精准化诊疗策略提供了依据。

复旦大学附属华山医院神经外科张启麟副研究员、韩瑞博士、叶蓁博士、蔡逸欣博士,复旦大学生物医学研究院许梓妍博士、赵江燕硕士,复旦大学人类表型组研究院王云之副研究员,复旦大学生命科学学院朱家俊博士、张范博士等为该论文的并列第一作者。复旦大学人类表型组研究院丁琛研究员、复旦大学附属华山医院神经外科赵曜教授和国家蛋白质科学中心(北京)贺福初院士为该论文的共同通讯作者。
该论文主要受到国家重点研发计划(2022YFA1303200和2022YFA1303201)、国家自然科学基金(U21A20389、U21A20389、82073640和 82373119)、中国医学科学院医学与健康科技创新工程(2021-I2M-C&T-A-025和2023-I2M-C&T-B-125)、国家高技术研究发展计划(863计划,2014AA020611)、国家杰出青年科学基金(81725011)、上海市申康项目(2020CR2004A)的资助。本研究同时得到中国垂体腺瘤协作组的支持。
通讯作者简介
丁琛 教授
复旦大学人类表型组研究院
复旦大学人类表型组研究院副院长、复旦大学生命科学学院教授、遗传工程国家重点实验室PI、复旦大学附属中山医院双聘教授,博士生导师
目前担任中国生物物理学会表型组学分会创会秘书长、Springer Nature旗下《Phenomics》杂志创刊执行主编、国家十四五重点研发计划“生物大分子与微生物”首席科学家
入选国家高层次人才特殊计划、国家海外高层次人才计划、北京市“海聚工程”、北京市“优秀青年人才”、上海市“曙光人才”、上海市“优秀学科带头人”
近五年在Nat Biotechnol、Adv Sci、Sci Adv、JHO、Hepatology、Nat Commun等杂志发表文章69篇,其中独立/共同通讯SCI论文38篇,被引4100次;获批中/美专利5项,申请中国专利10项
赵曜 教授
复旦大学附属华山医院
二级教授、主任医师、博士生导师
教育部长江学者特聘教授、国家杰青、国家万人计划领军人才
国家神经疾病医学中心(华山)副主任
复旦大学附属华山医院西院院长
复旦大学附属华山医院神经外科副主任
复旦大学神经外科研究所副所长
中国垂体腺瘤协作组组长
中国老年医学会神经外科分会副会长
中华医学会神经外科分会青年委员会副主任委员
华山医院垂体瘤多学科融合团队的学科带头人
【华山·金垂体】之临床和学术品牌的首倡者
识别二维码,前往赵曜 教授学术主页
查看更多精彩内容
贺福初 院士
国家蛋白质科学中心(北京)
中国科学院院士,发展中国家科学院院士
国家蛋白质科学中心(北京)理事长
在国际上率先提出人类蛋白质组计划的科学目标与技术路线,倡导并领衔了人类第一个组织、器官的国际“肝脏蛋白质组计划”,揭示了人体首个器官(肝脏)的蛋白质组;领衔实施“中国人蛋白质组计划”,该计划完成了我国人群常见十大肿瘤的蛋白质组学分析,开蛋白质组学独立完成肿瘤分子分型之先河;发现胆固醇代谢重编程是肝癌发生发展的重要机制,率先提出并实践“蛋白质组学驱动的精准医学”新范式
曾获人类蛋白质组组织“杰出贡献奖”和“杰出成就奖”,国家科技进步奖一等奖1项、二等奖3项,国家自然科学二等奖2项及何梁何利奖、求是奖等
在Nature、Science、Cell等国际核心刊物发表论文300余篇