颅底脊索瘤是以侵袭性强,复发率高为特点的颅底恶性骨肿瘤。因手术难全切,残瘤的治疗手段又极为有限(放疗抵抗率高,无切实有效的靶向药物),该类患者总体预后极差。
2022年9月20日,国家神经疾病医学中心、复旦大学附属华山医院神经外科赵曜教授团队和浙江大学郭国骥教授团队合作在Cell Discovery杂志在线发表题为“Single-cell transcriptome reveals cellular hierarchies and guides p-EMT-targeted trial in skull base chordoma”的研究论文,该研究利用单细胞RNA测序技术首次在颅底脊索瘤恶性细胞中发现了的一簇干细胞样细胞簇,且该细胞簇与肿瘤的放疗抵抗密切相关。同时,该研究还揭示肿瘤细胞内存在p-EMT (partial epithelial-mesenchymal transition)过程,与脊索瘤的侵袭性密切相关,可作为预后标志物和治疗新靶点。在此基础上,作者开展了I期临床实验,并在3个脊索瘤病人中证实了服用p-EMT抑制剂(YL-13027)可以显著减缓肿瘤生长,保持至少6个月的无进展状态。
颅底脊索瘤(Skull Base Chordoma, SBC)是一种罕见的源自斜坡或鞍区脊索残留组织的恶性骨肿瘤。由于肿瘤位置深在,临近重要组织(脑干)、血管(颈内动脉、基底动脉)及神经(视神经、动眼神经等),手术全切难度高,往往导致肿瘤残留,复发率极高。此外,残瘤对常规放射治疗不敏感,尚没有公认有效的药物,导致颅底脊索瘤患者往往在经历数次“手术-复发”之后将面临“无药可医”的困境。因此,针对颅底脊索瘤发病机制的研究及治疗靶点的研发亟待开展。
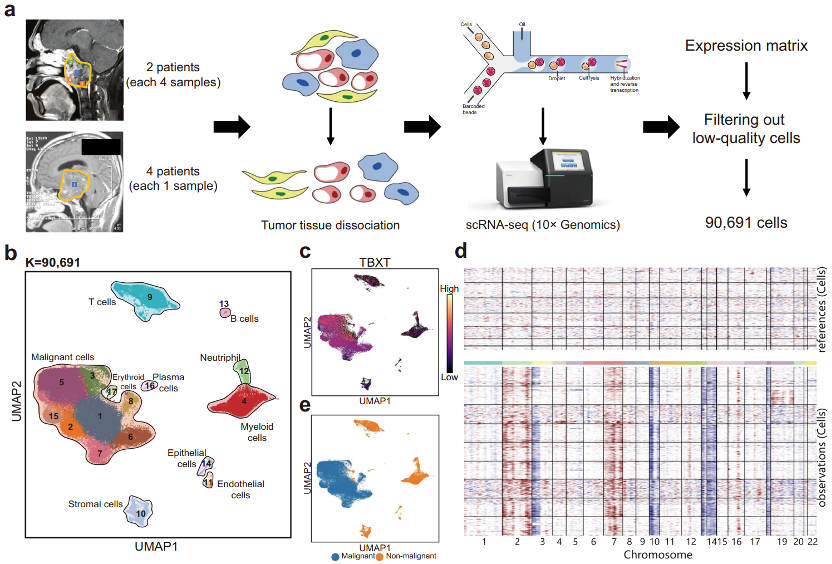
作者利用单细胞RNA测序技术从12例颅底脊索瘤样本(来自6名患者)中共测定90691个细胞,绘制了颅底脊索瘤单细胞转录组图谱。所有细胞被划分为10种亚型共17簇细胞,并且运用infer CNV及脊索瘤相关标志物鉴定出恶性细胞(即肿瘤细胞)及非恶性细胞(间质细胞、免疫细胞等)。
其中,肿瘤细胞根据基因表达差异,被进一步划分成6个亚群。之后利用干细胞打分,发现其中一个亚群(cluster 3)在恶性细胞中具有较高的干细胞特征,结合差异基因通路富集分析及单细胞轨迹分析技术(scVelo),初步推定其为颅底脊索瘤肿瘤干细胞簇。
为了进一步探索该干细胞簇与脊索瘤放疗抵抗的相关性,作者对颅底脊索瘤细胞系进行X光照射,并将照光前后的肿瘤细胞进行RNA-seq分析,利用差异表达基因,共富集出3个模块,其中Module2富集出的packaging of the telomere ends通路中的CTSL在前述脊索瘤干细胞簇中也高表达。后续的体外实验初步验证了CTSL的抑制剂(Z-FY-CHO)可以显著降低脊索瘤细胞系的放疗抵抗性,提示CTSL可作为颅底脊索瘤放疗增敏剂的潜在靶点。
研究利用非负矩阵分解(NMF)对脊索瘤肿瘤细胞进行聚类,发现脊索瘤肿瘤细胞中存在8个模块,首次明确脊索瘤中存在p-EMT(partial epithelial-mesenchymal transition)过程。后续通过体外细胞实验、裸鼠成瘤实验和及187例颅底脊索瘤患者的临床数据回顾,明确了p-EMT与脊索瘤侵袭性的相关性,抑制TGF-β通路可以显著下调脊索瘤中的p-EMT过程,从而抑制脊索瘤的侵袭性。
在此基础上,作者进一步开展了一项I期、单臂、开放标签的临床试验。所用药物YL-13027经体外及动物实验,能够显著抑制脊索瘤中p-EMT过程。入组的3名颅底脊索瘤患者服药后肿瘤生长均得到抑制,并且保持了至少6个月的无进展状态。
综上所述,该研究首次在单细胞层面发现了颅底脊索瘤中存在的干细胞亚群及p-EMT过程,并在实验室中验证了放疗增敏剂及p-EMT抑制剂的治疗效果。后续的临床试验则进一步证实了p-EMT抑制剂的临床效果。该研究为脊索瘤的药物研发提供了新的思路,为脊索瘤患者的治疗带来了新的曙光。
复旦大学附属华山医院的张启麟医生、韩瑞博士、黄若凡教授、王镛斐教授、陈宏教授,浙江大学费丽江博士为本研究的第一作者;国家神经疾病医学中心、复旦大学附属华山医院神经外科赵曜教授、浙江大学郭国骥教授为本研究的通讯作者。