
【Ref: Ma, ZY.,Song, ZJ., Chen, JH., Wang,YF., Zhao, Y.etc. Recurrent gain-of-function USP8 mutations in Cushing's disease. Cell Res. 2015 Mar;25(3):306-17.】
库欣病是指垂体促肾上腺皮质激素(ATCH)腺瘤或ACTH细胞增生,分泌过多ACTH,引起肾上腺皮质增生,产生皮质醇增多症,从而导致的一系列代谢紊乱和病理变化。该病临床危害极为严重,累及全身多个重要脏器, 若不及时诊治,死亡率较正常人群高四倍。然而,目前国内外对于库欣病的遗传发生机制并不明确,成为无法制定精确治疗方案的一个重要因素。近期,上海复旦大学附属华山医院神经外科赵曜、王镛斐、李士其教授团队和上海交通大学师咏勇、黄传新教授团队合作,完成了针对库欣病遗传发生机制的研究,其最新成果表明:肿瘤内普遍发生的USP8基因突变最终导致了ACTH过度分泌,从而引发库欣病。国际一流学术期刊《Cell Research》(影响因子12 )于2015年第3期对这项研究成果刊登发表并进行了封面介绍。
该项研究纳入了2003-2014年间在华山医院神经外科接受手术治疗的垂体瘤患者共计258例。研究者利用全外显子测序技术对其中12例ATCH分泌型垂体瘤样本进行分析,发现有8例样本存在USP8基因突变。而在此基础上进行的大样本量垂体瘤USP8基因突变验证表明,有62%的 ATCH分泌型垂体瘤样本中存在USP8突变。与此同时,研究者对照了病人的临床资料,发现USP8突变的肿瘤多发生在垂体微腺瘤当中(P<0.001)。该研究团队继而利用293T及大鼠垂体瘤细胞系进一步揭示了USP8突变后的作用机制, 即USP8基因突变使其丧失与14-3-3蛋白的结合能力,继而导致本身的去泛素化能力增强,使得EGFR的降解减少,而细胞内EGFR的蓄积最终导致了ATCH的过度分泌。最后,研究者在人原代肿瘤细胞培养中加入Gefitinib(一种EGFR抑制剂),证实肿瘤细胞经过抑制后,ACTH的分泌能力下降超过50%。最后作者认为该项研究为库欣病的分子诊疗提供了充足的理论和实验依据,其提出的抑制USP8及下游分子是USP8突变型促肾上腺皮质激素腺瘤的有效且极具潜力的个体化治疗方案。
该项研究是迄今国际上关于库欣病分子遗传学机制的最大样本量研究。美国内分泌学会副主席、哈佛医学院附属Brigham and Women's Hospital 内分泌科主任Ursula Kaiser教授本月初针对该项研究结果专门撰写评论(Highlight),指出USP8基因突变是一个高频且在ACTH型垂体瘤中特有的突变,这个令人振奋的发现把库欣病的治疗带入了精准医疗时代。
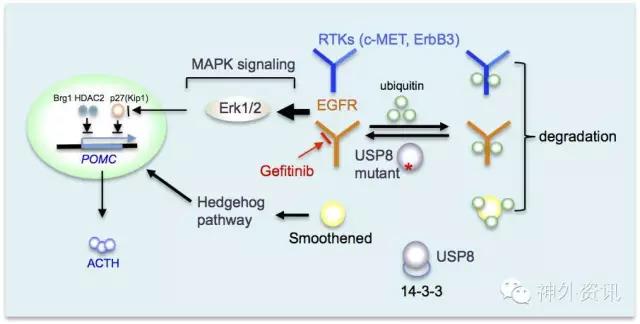
图1:USP8突变引起ACTH分泌增高的可能分子机制。14-3-3蛋白失去了对突变型USP8的调节,突变型USP8降低了EGFR的泛素化水平;引起细胞内EGFR的蓄积,最终导致ATCH过度分泌。
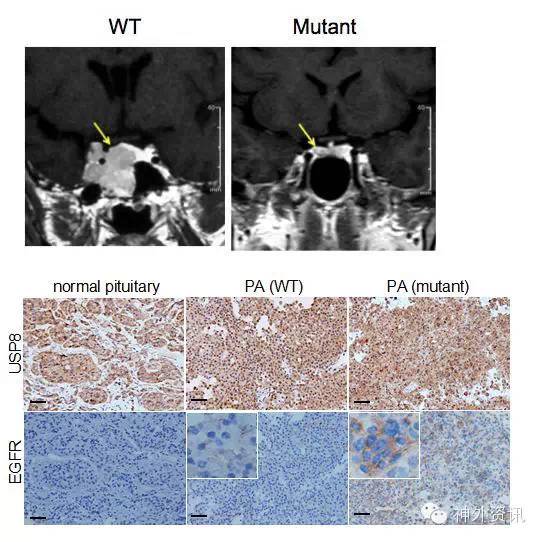
图2上:USP8突变型多发生在ACTH垂体微腺瘤中。图2下:免疫组化示正常垂体、野生型及突变型肿瘤中USP8及EGFR蛋白表达量逐量递增。
(复旦大学附属华山医院马增冀博士编译,复旦大学附属华山医院赵曜教授审校)

